Je vais essayer dans cet article de vous partager ce que sont les enzymes, ces merveilleux catalyseurs biologiques, sans avoir recours à des explications trop scientifiques. Pour comprendre le fonctionnement des enzymes, il faut les voir comme des travailleurs spécialisés du corps humain, travailleurs que nous avons décidé chez Biovie de surnommer des "auxiliaires métaboliques", car les enzymes n'apportent aucun nutriment (ce ne sont pas des compléments alimentaires) ; elles nous aident à optimiser les fonctions du corps, qu'elle soient métaboliques ou digestives, à travers un grand nombre de réactions biochimiques.
Les enzymes, c'est quoi au juste ?
Chez les organismes vivants, les enzymes sont des protéines qui accélèrent une grand nombre de types de réactions biochimiques et de réactions chimiques nécessaires à la vie. Imaginez une unité de production où chaque machine (enzyme) est conçue pour effectuer une tâche spécifique rapidement et efficacement. Ces machines (enzymes) sont cruciales pour découper les macro nutriments en plus petites unités assimilables, transformer les nutriments en énergie, réparer nos cellules et nos organes et bien d'autres fonctions vitales.
Chaque enzyme intervient dans une réaction biochimique très précise, elle est unique et ne fonctionne que sur un type particulier de "pièce", c'est à dire une molécule de substrat avec laquelle est présente une complémentarité de forme, comme deux pièces de puzzle en 3D pour sa propre réaction enzymatique. On parle de spécificité de substrat. L'enzyme s'accroche à cette pièce et la transforme, permettant ainsi à des réactions complexes de se produire rapidement et sans gaspiller d'énergie. C'est un peu comme une clé qui ouvre une serrure spécifique : l'enzyme (clé) ne fonctionne que sur son substrat (serrure). C'est ce qu'on appelle l'activité enzymatique, et c'est ce qui caractérise d'ailleurs la différence entre le vivant et l'inerte.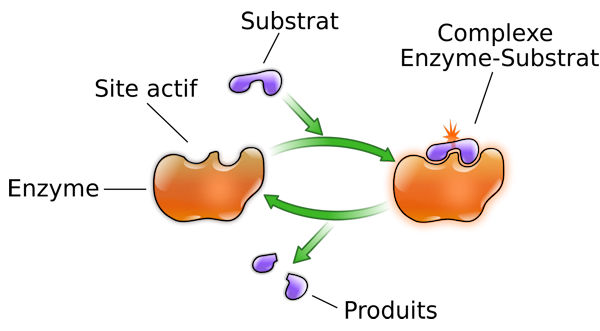
(source : Wikipedia)
Les enzymes sont aussi réutilisables et recyclables, elles ne sont pas "usées" par leur utilisation. C'est d'ailleurs la définition même d'une réaction catalytique : on retrouve la substance responsable de la réaction intacte en fin de réaction. Après avoir transformé un substrat, elles sont libres de recommencer avec un autre. Grâce à cela, même en petite quantité, elles peuvent réaliser beaucoup de réactions en peu de temps, et lorsqu'elles sont dans leur environnement de fonctionnement optimal, en particulier à température corporelle, elles sont très rapides.
En matière de santé, les enzymes sont essentielles. Elles participent à tout, de la digestion des aliments à la réparation de l'ADN. Quand elles ne fonctionnent pas correctement, cela peut causer des problèmes sérieux, comme des maladies génétiques, des troubles auto-immuns, et même certains cancers.
Enfin, il est important de savoir que les enzymes que nous produisons et celles que nous consommons dans les aliments jouent des rôles différents, mais toutes sont importantes pour un métabolisme sain.
Pour mieux comprendre, on peut comparer les enzymes à des assistants personnels très efficaces dans le corps. Elles s'occupent de tout, de la conversion des aliments en énergie utilisable à la gestion des déchets cellulaires. C'est comme si chaque processus métabolique avait son propre assistant dédié, garantissant que tout fonctionne sans heurts et à un rythme soutenu.
L'aspect fascinant des enzymes est leur précision extrême. Elles ne se contentent pas de travailler sur n'importe quelle réaction chimique ; elles ciblent des réactions spécifiques. Cette spécificité empêche le chaos métabolique en s'assurant que les bonnes réactions se produisent au bon endroit et au bon moment.
Les enzymes jouent également un rôle clé dans notre santé en régulant les voies métaboliques. Elles agissent comme des régulateurs de vitesse, accélérant ou ralentissant les réactions selon les besoins de notre corps. Lorsque ce système est perturbé, des déséquilibres peuvent survenir, entraînant des problèmes de santé.
Par exemple, si une enzyme clé est déficiente ou absente en raison d'une mutation génétique par exemple, cela peut entraîner une maladie métabolique et des problèmes en cascade. Inversement, si une enzyme est trop active, les processus s'emballent littéralement cela peut conduire à des maladies auto-immunes voir à certains types de cancer.
En résumé, les enzymes sont des acteurs indispensables dans le théâtre complexe de notre métabolisme. Leur rôle dans le maintien de notre santé est aussi crucial qu'invisible, orchestrant discrètement une multitude de processus vitaux qui nous permettent de vivre, de grandir et de rester en bonne santé.
Rôles des enzymes dans l'organisme
Les enzymes, ces auxiliaires métaboliques jouent un rôle indispensable dans notre corps, nous l'avons vu. Elles accélèrent et facilitent de nombreuses réactions biochimiques essentielles à notre vie quotidienne. Voici quelques exemples concrets de leur action :
Glycolyse : Cette réaction biochimique, c'est un peu comme décomposer une pièce complexe (le sucre, le glucose) pour en extraire de l'énergie (ATP) et d'autres composants utiles. Plusieurs enzymes collaborent ici, et si elles ne fonctionnent pas bien, cela peut entraîner des problèmes tels que la baisse du niveau de sucre dans le sang, la faiblesse musculaire, et d'autres troubles métaboliques.
Digestion : Imaginez des outils spécialisés (enzymes digestives) qui en découpant les liaisons chimiques, réduisent les aliments en petites molécules (nutriments) que notre corps peut utiliser. Ces réactions commencent dès le début du tube digestif, grâce aux enzymes produites par les glandes salivaires, par exemple, les protéine sont découpées en acide aminés. Si ces enzymes-outils sont défectueux, la digestion est compromise, ce qui peut mener à des problèmes de malnutrition, de douleurs abdominales, de ballonnements et de diarrhée, et surtout de mauvaise assimilation de ce que nous mangeons, quelque soit la qualité de ces aliments.
Réparation de l'ADN : Les enzymes de réparation de l'ADN agissent comme de véritables techniciens de maintenance, repérant et réparant les différents dégâts constatés sur notre matériel génétique. Si elles ne fonctionnent pas correctement, cela peut provoquer des mutations génétiques, augmenter le risque de cancer et accélérer le vieillissement.
Cycle de l'urée : Ce processus convertit l'ammoniac toxique en une substance moins dangereuse (urée) que notre corps peut facilement éliminer par les reins. Les enzymes impliquées dans ce processus sont cruciales ; leur dysfonctionnement peut entraîner une accumulation d'ammoniac dans le sang, nuisant gravement au cerveau et à d'autres organes.
Synthèse de l'hémoglobine : L'hémoglobine, portée par nos globules rouges, est essentielle pour transporter l'oxygène dans tout le corps. Si l'enzyme responsable de sa production est déficiente, cela peut causer une anémie, entraînant fatigue, faiblesse, essoufflement et pâleur.
En bref, les enzymes sont des acteurs clés dans des processus vitaux, qu'il s'agisse de réactions anaboliques (construction de molécules) ou de réactions cataboliques (décomposition de molécules), et leur bon fonctionnement est essentiel pour notre santé et notre bien-être.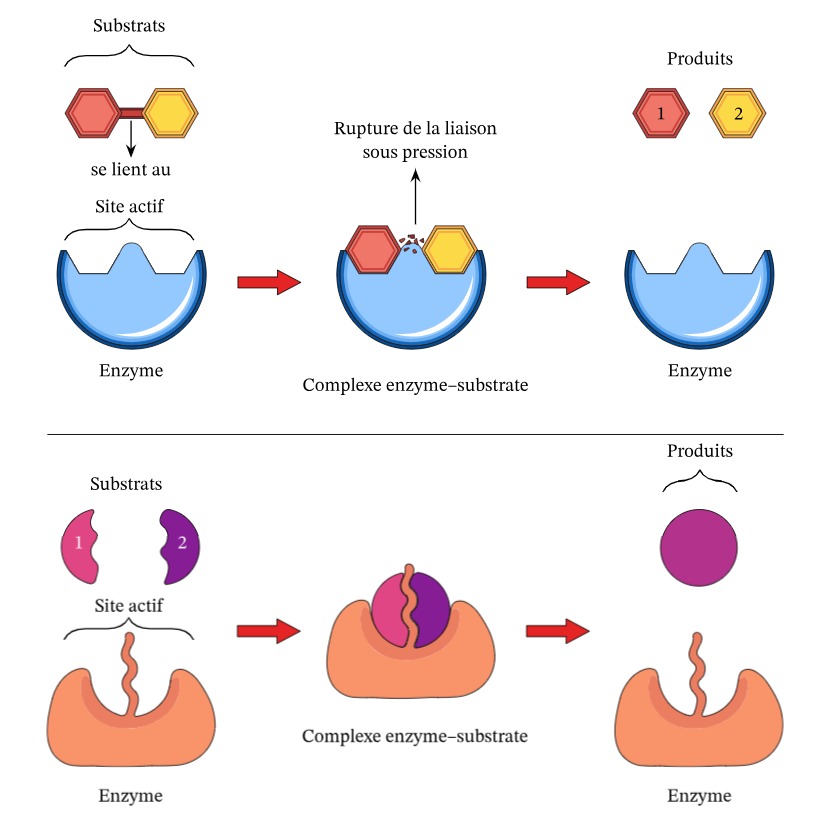
Enzymes et température
À haute température, les liaisons internes des enzymes se rompent et l'enzyme perd sa forme (on appelle cela sa structure tridimensionnelle) ; leur activité cesse, les cellules vivantes deviennent des cellules mortes. A cette température un aliment perd ses enzymes alimentaires intrinsèques. Cela explique pourquoi les aliments cuits au delà d'une certaines température sont moins digestes que les aliments crus, car les aliments cuits ne possèdent plus ces enzymes internes, le corps humain, plutôt que d'en bénéficier, doit donc en fabriquer de nouvelles pour digérer les aliments correctement, ce qui a un coût biologique bien sûr. En d'autres termes, les enzymes digestives sont détruites par la chaleur de la cuisson et notre organisme ne peut plus en bénéficier, et les réactions enzymatiques n'ont plus lieu. En revanche, à des températures inférieures à la température du corps, les enzymes restent actives.
Les enzymes sont sensibles à la chaleur, un peu comme des sculptures de glace complexes et délicates. Chaque enzyme a une forme tridimensionnelle spécifique, maintenue ensemble par des liaisons fragiles. Cette forme est cruciale pour leur fonctionnement, car elle leur permet de s'accrocher à leurs substrats et d'accélérer les réactions chimiques. Comme une pièce de puzzle sensible à la chaleur, qui se déformerait de façon irréversible en fondant au dessus de sa température de fusion :
Influence de la Température : Chaque enzyme a une "température idéale" où elle fonctionne le mieux, souvent proche de la température corporelle de l'organisme dont elle provient. Par exemple, les enzymes humaines sont optimales autour de 37°C. À cette température, elles sont assez souples pour effectuer leurs tâches efficacement.
Effet de la Baisse de Température : Quand il fait plus froid, les enzymes ralentissent. Elles bougent moins et interagissent moins avec leurs substrats, ce qui diminue la vitesse des réactions qu'elles catalysent. Heureusement, les basses températures ne détruisent généralement pas les enzymes de façon permanente.
Effet de l'Augmentation de la Température : Par contre, quand la température augmente, les enzymes s'activent d'abord et fonctionnent plus rapidement, mais si la température monte trop, elles commencent à se déformer et perdent leur capacité à fonctionner. Cette perte de structure (dénaturation) est irréversible ; une fois détruite, l'enzyme ne peut pas se réparer. C'est la raison principale pour laquelle nous préconisons une alimentation le moins cuite possible, pour préserver le capital enzymatique de nos aliments.
Dans nos aliments, les enzymes sont quasiment toujours détruites pendant la cuisson ou le traitement industriel, car ces processus utilisent des températures bien au-delà de leur seuil de tolérance à la chaleur. Cette température varie en fonction du type d'enzyme, par exemple, la pectinase est désactivée autour de 50°C, l'amylase vers 70°C, la protéase et la catalase vers 60°C.
Enfin, une légère augmentation de la température corporelle, comme lors d'une fièvre, peut booster notre système immunitaire. Cette chaleur supplémentaire mais non destructive accélère les enzymes impliquées dans la défense de notre corps, aidant ainsi à combattre les infections plus efficacement et rapidement. Certaines enzymes clés du système immunitaire, comme les interférons, peuvent même être plus actives à des températures légèrement plus élevées que la normale.
A suivre : nous parlerons dans deux autres articles de deux catégories spécifiques d'enzymes ; les enzymes digestives et les enzymes métaboliques.
Sources :
Berg, J.M., Tymoczko, J.L., Gatto, G.J., & Stryer, L. (2015). Biochemistry (8th ed.). New York: W.H. Freeman and Company.
Voet, D., Voet, J.G., & Pratt, C.W. (2013). Fundamentals of Biochemistry: Life at the Molecular Level (4th ed.). Hoboken, NJ: John Wiley & Sons.
Nelson, D.L., & Cox, M.M. (2017). Lehninger Principles of Biochemistry (7th ed.). New York: W.H. Freeman and Company.
Sharma, H. K., Prasad, K., & Dinesh, M. R. (2011). Biochemistry and Biotechnology of Pectinases: A Review. International Journal of Food and Fermentation Technology, 1(1), 1-15.
P. M. Nielsen (1994) Functionality of exogenous enzymes in dough systems. In: Journal of Cereal Science, 20(1): 47-57.
V. C. Pandey et al. (2000) Enzyme technology in food processing. In: Journal of Food Science and Technology, 37(2): 123-135.
A. K. Mondal et al. (2012) Catalase Activities, Stability and Kinetics: A Comparative Study. In: Journal of Microbiology, Biotechnology and Food Sciences, 1(5): 1205-1214.
Berg, J. M., Tymoczko, J. L., & Stryer, L. (2002). Biochemistry (5th ed.). New York: W.H. Freeman. (Le chapitre 8, "Enzymes: Basic Concepts and Kinetics"
Isaacs, A., Lindenmann, J., & Valentine, R. C. (1957). Virus interference. II. Some properties of interferon. Proceedings of the Royal Society of London. Series B - Biological Sciences, 147(927), 268–273. doi: 10.1098/rspb.1957.0048.








